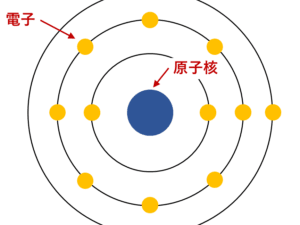
原子と原子核は、物質を構成する重要な要素ですが、その役割や構造には明確な違いがあります。まず、原子は、物質の基本単位であり、元素の性質を決定する最小の単位です。原子は、中心にある原子核と、その周りを回る電子から構成されています。一方で、原子核は、原子の中心部分に位置し、陽子と中性子から成り立っています。このように、原子と原子核は、相互に関連しながらも異なる存在であることがわかります。
原子の構造を理解することは、化学反応や物理現象を知るうえで非常に重要です。例えば、原子は結合して分子を形成し、様々な物質の特性を生み出します。対照的に、原子核は、元素の同位体や放射線の特性に関与し、核反応や放射能にも深く関わっています。したがって、原子と原子核の違いを理解することは、科学の基礎を学ぶ上で欠かせないステップと言えるでしょう。
このように、相違点を知ることで、原子と原子核についての理解が深まり、物質の性質や振る舞いを探求するための新しい視点を得ることができます。これから、原子と原子核の違いについてさらに詳しく見ていきましょう。あなたの科学への興味を広げる手助けとなる情報が満載ですので、ぜひ読み進めてください。
Contents
原子と原子核の基本的な違いとは?
原子と原子核は、物質の基本的な構成要素でありながら、異なる役割と性質を持っています。これらの違いを理解することは、化学や物理学の基礎を学ぶ上で重要です。
まずは、用語の定義から始めましょう。
原子とは、物質を構成する最小の単位であり、化学的な性質を持つ粒子です。原子は、中心に原子核があり、その周囲を電子が回っています。原子は通常、陽子、電子、中性子などの基本的な粒子から構成されています。
原子核は、原子の中心部分であり、陽子と中性子で構成されています。陽子は正の電荷を持ち、中性子は電荷を持たない中性的な粒子です。原子核は非常に小さいですが、原子全体の質量のほとんどを占めています。
原子と原子核の主な違いは以下の通りです。
- 構成要素: 原子は原子核と電子から成り立っているが、原子核は陽子と中性子から成り立っています。
- 電荷: 原子は全体として電気的に中性であるが、原子核は陽子の数によって正の電荷を持つ。
- サイズ: 原子核は原子の中心に位置し、原子全体のサイズに対して非常に小さい。
- 役割: 原子は化学反応において重要であり、原子核はその安定性や放射能に関連する。
- 質量: 原子核は原子の質量の大部分を占める。
次に、それぞれの要素について詳しく説明します。
### 原子の詳細
原子は、さまざまな元素を形成する基本単位であり、各元素は異なる数の陽子を持つため、異なる化学的特性を示します。原子内の電子は、エネルギー準位を持ち、これが化学反応や結合に影響を与えます。また、原子の中性子の数が変わることで同位体が形成され、これが質量や安定性に影響を与える要因となります。
### 原子核の詳細
原子核は、陽子と中性子から成り、非常に強い力で結合されています。この力を核力と呼びます。原子核のサイズは非常に小さいものの、高い密度を持ち、ほとんどの質量がここに集中しています。原子核は不安定な状態になることがあり、これを放射性崩壊と呼びます。この時、原子核はエネルギーや他の粒子を放出します。
### 原子と原子核の相互作用
原子と原子核は、化学的および物理的な性質において密接に相互作用します。原子は化学反応を通じて他の原子と結びつき、新しい物質を形成します。一方、原子核の性質や挙動は、放射線や核反応に関与し、その結果、さまざまなエネルギー源(核エネルギーなど)を生み出します。
### 原子と原子核の相違点の比較表
原子と原子核の違いの比較表
| 項目 | 原子 | 原子核 |
|---|---|---|
| 構成要素 | 陽子、電子、中性子 | 陽子、中性子 |
| 電荷 | 中性 | 陽子の数により正 |
| サイズ | 大きめ | 非常に小さい |
| 役割 | 化学反応に関与 | 核反応に関与 |
| 質量 | 原子全体の質量の一部 | ほとんどの質量を占める |
| 安定性 | 安定でも不安定な場合もあり | 放射性崩壊がある |
| 相互作用 | 化学結合を形成 | 核力で結合 |
| 発見された年 | 19世紀初頭 | 20世紀初頭 |
| 利用 | 化学工業、医学など | 核発電、医療用放射線など |
【化学擬人化ドラマ】元素記号がクラスメイトだったら
NO THANX★原子炉が起動する決定的瞬間★NO NUKES720P
原子核と陽子の違いは何ですか?
原子核と陽子の違いについて説明します。
まず、原子核とは、原子の中心部分に位置し、陽子と中性子から構成されているものです。すべての原子核は、原子の質量の大部分を占めています。
一方で、陽子は、原子核を構成する基本的な粒子の一つで、正の電荷を持っています。陽子の数は、その原子の種類(元素)を決定します。
したがって、要約すると:
- 原子核は、陽子と中性子を含む原子の中心部分。
- 陽子は、原子核を構成する粒子であり、正の電荷を持つ。
このように、原子核と陽子は、構造と役割において明確な違いがあります。
原子核とは何ですか?
原子核とは、原子の中心に存在する非常に小さな領域であり、主に陽子と中性子から構成されています。これらの粒子は、原子の質量の大部分を占めており、原子の化学的性質や安定性にも大きな影響を与えます。
原子核は、原子全体の電荷を決定する陽子の数によって異なる元素が区別され、また中性子の数によって同位体が形成されます。このように、原子核の構成要素やその数の違いが、元素間の相違点を生む重要な要因となっています。
すなわち、原子核は物質の基本的な構造を理解するための鍵であり、他の原子や元素との相違点を明確にする上でも非常に重要です。
原子核と原子の直径はどれくらいですか?
原子核と原子の直径には大きな違いがあります。
まず、原子核の直径は約1フェムトメートル(10-15メートル)程度です。これは非常に小さなサイズであり、原子全体のサイズと比較すると非常に微細です。
一方、原子の直径はおおよそ0.1ナノメートル(10-10メートル)、つまり100ピコメートル程度です。これは原子核よりもはるかに大きく、原子のサイズは主に電子が存在する領域によって決まっています。
このように、原子核は極めて小さいのに対し、原子全体はそれに比べてかなり大きいということが、両者の最も顕著な相違点です。
原子とは何ですか?
原子とは、物質を構成する最も基本的な単位であり、すべての元素を形成する要素です。原子は、中心にある原子核と、その周りを回る電子から成り立っています。原子核は、プロトンと中性子で構成されており、プロトンの数がその元素の原子番号を決定します。各原子は特定の化学的特性を持っており、この特性によって他の原子との相互作用が変わります。
相違点において重要なのは、原子は物質の性質や反応を決定する基盤であるため、異なる元素の原子が異なる特性を持つことです。このため、元素間の相違点が化学的反応や物質の性質に大きな影響を与えるのです。例えば、酸素原子と炭素原子では、結合の仕方や反応性が異なります。これは、原子の構造や電子配置に起因します。
よくある質問
原子と原子核の定義は何ですか?
原子とは、物質の基本的な単位であり、電子、陽子、および中性子から構成されています。一方、原子核は、原子の中心部分であり、主に陽子と中性子で構成されているため、原子と原子核の相違点は、その構成要素と位置にあります。
原子の構造について詳しく教えてください。
原子の構造は、主に原子核と電子から成り立っています。原子核は陽子と中性子で構成されており、その周りを電子が回っています。これにより、異なる元素が形成される際の相違点が生まれます。例えば、陽子の数が異なることで、元素の種類や性質が変わります。
原子核の役割は何ですか?
原子核の役割は、原子の質量をほとんど決定し、化学的性質を決定する電子との相互作用を通じて原子の安定性を保つことです。また、放射能や核反応に関与し、エネルギーの源ともなります。
原子と原子核のサイズの違いはどのくらいですか?
原子と原子核のサイズには大きな違いがあります。原子のサイズは約0.1ナノメートル(1オングストローム)ですが、原子核のサイズは約10のマイナス15乗メートル(フェムトメートル)です。つまり、原子核は原子のサイズに比べて非常に小さいことがわかります。
原子核の安定性はどうやって決まるのですか?
原子核の安定性は、主に中性子と陽子の比率によって決まります。一般的に、原子核には十分な中性子が必要で、これにより強い相互作用が安定を保ちます。また、原子番号が大きくなるにつれて、より多くの中性子が必要になります。このように、原子核の安定性は、粒子の種類と数の相違点によって影響されます。
原子と原子核の違いについて考えると、両者はそれぞれ独自の役割を持っています。原子は物質の基本単位であり、さまざまな元素を構成しています。一方で、原子核は原子の中心に位置し、陽子と中性子から成る最も重要な部分です。この理解を深めることで、科学に対する視野が広がるでしょう。